
Revisión de la nueva norma ISO 11138-8 relativa a la validación de un tiempo de incubación reducido para indicadores biológicos
Por Kurt McCauley
[ Leer en: Inglés | Italiano | Francés ]
Mesa Labs fabrica sus indicadores biológicos (IB) de conformidad con las normas relevantes. Recientemente se ha publicado una nueva norma ISO relativa a la validación de un tiempo de incubación reducido (RIT) para IB, la cual es objeto de análisis de este boletín de Spore News. La norma, que ha recibido la designación ISO 11138-81 , es la última incorporación a la serie ISO 11138, dedicada íntegramente a los IB. Esta norma va dirigida a fabricantes de IB y a usuarios finales que deseen establecer o confirmar un RIT.
Antes de la publicación de la ISO 11138-8, el único método RIT disponible lo había publicado la Agencia para el Control de Alimentos y Medicamentos de los Estados Unidos (FDA)2 en el año 1986, el cual fue incluido en un documento de orientación de la FDA titulado "Biological Indicator (BI) Premarket 510(k) Submissions" (Presentación de notificación previa a la comercialización 510(k) para indicadores biológicos (IB))3 . Este método fue aceptado de forma general a nivel mundial, y ha sido ampliamente utilizado durante décadas; sin embargo, en los últimos años varias organizaciones localizadas fuera de los EE. UU. empezaron a rechazar dicho método de ensayo, en parte porque se trataba de un método específico de las regulaciones de EE. UU. Para terminar de complicar las cosas, algunas divisiones dentro de la propia FDA (como el Centro de Evaluación e Investigación de Medicamentos) dejaron de reconocer este método (desarrollado por el Centro de Dispositivos y Salud Radiológica de la FDA), poniendo en una situación difícil a muchos fabricantes de productos estériles. Nunca se llegaron a ofrecer argumentos convincentes que justificaran la decisión de rechazar un método utilizado desde mucho tiempo, salvo por el hecho de que la FDA no pudo presentar pruebas que respaldaran el desarrollo del método. En el momento de redactar este documento, el método de la FDA sigue contando con una amplia aceptación, en gran parte porque hasta julio de 2021, fecha de la publicación del método ISO 11138-8, no se había presentado ningún método alternativo.
El grupo de trabajo 4 (WG4) de ISO/TC 198, Esterilización de productos sanitarios - Indicadores biológicos, fue el responsable de desarrollar la norma RIT. El Dr. John Gillis tuvo un papel clave en este proceso, y dirigió numerosos estudios que dieron como resultado varias publicaciones4,5,6. En abril de 2012, Schneider y Gillis7 ofrecieron un historial detallado del proyecto RIT, que se inició en 2000, se retrasó durante varios años, y se reactivó en 2007. A lo largo de los más de 20 años de vida del proyecto, el WG4 propuso, probó y desestimó numerosos métodos para la determinación del RIT. Como suele suceder con la elaboración de normas, el desarrollo del método estuvo acompañado de un profundo debate. De un lado estaban quienes defendían que la última espora gravemente dañada que hubiera sobrevivido al proceso debía ser la que determinara el RIT. Este planteamiento fue rechazado porque se consideró innecesariamente restrictivo, y establecía el RIT en función de lo que la mayoría consideraba datos "atípicos". El argumento opuesto sostenía que el RIT debía basarse en las últimas 10-100 esporas gravemente dañadas. Este método eliminaba la necesidad de buscar la ventana de exposición de fracción negativa, la cual consumía mucho tiempo y recursos (uno de los desafíos que planteaba el método de la FDA). En lugar de eso, el tiempo de exposición se proporcionaba a través de un cálculo enfocado matemáticamente a un número reducido de esporas sobrevivientes; sin embargo, se consideró que este método era demasiado laxo, y resultaba difícil correlacionar el número calculado de esporas sobrevivientes con el número de esporas sobrevivientes determinado empíricamente.
Cuando el proyecto llegó a su fin, el método que surgió de los ensayos realizados a lo largo de todos esos años se encontraba en algún punto intermedio entre las dos opciones mencionadas anteriormente, y era inquietantemente similar al método de la FDA. Los aspectos comunes entre los métodos de la FDA y de la ISO incluyen el número de IB requeridos por ensayo, con un enfoque basado en una ventana de fracción negativa, y una correlación mínima del 97% entre el RIT y los resultados de 7 días. El método ISO permite una ventana de fracción negativa más amplia, pero su método está restringido únicamente a las modalidades de calor húmedo y óxido de etileno. El método ISO requiere el uso de un resistómetro8 o un esterilizador rigurosamente controlado para todos los ensayos. El método de la FDA no recoge esta condición de manera específica, si bien establece que los ensayos se realicen en un esterilizador de producción. Todos estos datos se resumen en la Tabla 1.
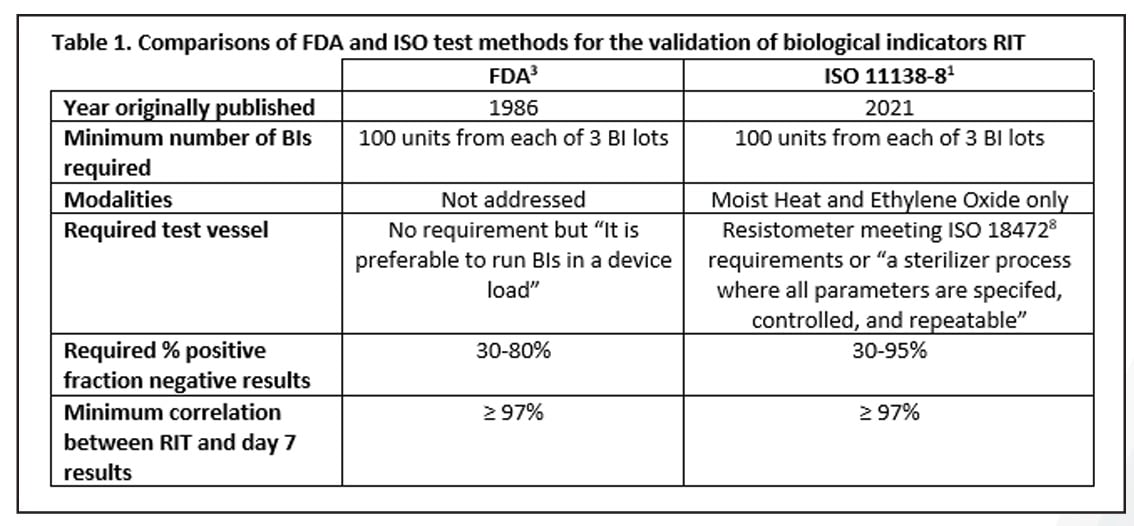
Una de las limitaciones de la norma ISO 11138-8, tal y como se indicó anteriormente, es que solo puede aplicarse con procesos de esterilización por calor húmedo y óxido de etileno. ¿Qué importancia tiene esto en relación con las demás modalidades de esterilización, como calor seco, que han sido validadas con éxito por el método de la FDA? La consecuencia más lógica sería que los fabricantes de IB continuaran validando estos IB según el método de la FDA, y que complementaran sus afirmaciones con datos recopilados a partir del método de validación de la ISO. Después de todo, ambos métodos son prácticamente idénticos.
Los usuarios finales se preguntan a menudo si ellos también están obligados a realizar estudios sobre el RIT en los IB usados en sus procesos. La ISO 11138-8 responde a esta pregunta cuando señala que "este documento va dirigido a fabricantes de indicadores biológicos (IB) y a usuarios finales de IB que deseen establecer, validar o confirmar un RIT, si así lo requiere su sistema de calidad".1 Además, la norma establece que no es necesario que los usuarios finales realicen esta prueba, al señalar que "la validación del RIT para una tira de esporas que incluye un medio de recuperación como un kit o un IB autónomo no debe ser repetida por el usuario final siempre que este utilice el IB con el mismo agente esterilizante y la misma temperatura de incubación del IB que se utilizó en la validación"1.
Con la publicación de la norma ISO 11138-8, se ha establecido un método de prueba desarrollado y reconocido internacionalmente para la validación de un RIT para indicadores biológicos.
La ISO señala cuatro principios clave en relación con el desarrollo de normas: estas deben responder a una necesidad del mercado, deben basarse en opiniones de expertos a nivel mundial, deben desarrollarse a través de un proceso con múltiples participantes, y deben basarse en un consenso.
La norma ISO 11138-8 cumple con todos estos criterios, y viene a completar de manera satisfactoria la serie ISO 11138-8.
Referencias
- ISO 11138–8: 2021, Esterilización de productos sanitarios. Indicadores biológicos. Parte 8: Método para la validación de un tiempo de incubación reducido para un indicador biológico.
- FDA Guide for Validation of Biological Indicator Incubation Time (1986).
- Guidance for Industry and FDA Staff - Biological Indicator (BI) Premarket Notification [510(k)] Submissions, 4 de octubre de 2007.
- J.R. Gillis, G. A. Mosley, J.B. Kowalski, G. Krushefski, P.T. Nirgenau, K.J. McCauley, "Understanding Biological Indicator grow-out Times", Pharmaceutical Technology, 34, (1), Jan 2010.
- J.R. Gillis, G. A. Mosley, J.B. Kowalski, G. Krushefski, P.T. Nirgenau, K.J. McCauley, P.M. Schneider "Understanding Biological Indicator Grow-Out Times--Part II", Pharmaceutical Technology, Jun 2013.
- J.R. Gillis P. M. Schneider, G. A. Mosley, J.B. Kowalski, G. Krushefski, K.J. McCauley "Establishing a Minimum Incubation Time for Biological Indicators", Pharmaceutical Technology, Dec 2013.
- P.M. Schneider, J.R. Gillis, "Biological Indicator Growout Times: The Impact on Establishing a Reduced Incubation Time Protocol", Pharmaceutical Technology, Vol 2012 Supplement, Issue 3 April 2012.
- ISO 18472: 2018, Esterilización de productos para la salud. Indicadores biológicos y químicos. Equipo de ensayo.
SN070-V1