
Esame della nuova norma ISO 11138-8 sulla convalida del tempo di incubazione ridotto per gli indicatori biologici
Di Kurt McCauley
[ Leggi: Inglese | Spagnolo | Francese ]
Mesa Labs produce i suoi indicatori biologici (BI) in conformità alle normative rilevanti. Una nuova norma ISO per la convalida del tempo di incubazione ridotto (RIT) per i BI é stata recentemente pubblicata ed é oggetto della presente Spore News. Lo standard è stato designato come ISO 11138-81 ed è l'ultima aggiunta alla serie ISO 11138 interamente dedicata ai BI. Questo standard è applicabile sia dai produttori di BI che dagli utenti finali che desiderano stabilire o confermare il RIT.
Fino alla pubblicazione della ISO 11138-8, l'unico metodo RIT disponibile era quello pubblicato nel 1986 dalla Food and Drug Administration (FDA)2 , e che da allora è stato incorporato in un documento di riferimento della FDA intitolato “Biological Indicator (BI) Premarket 510(k) Submissions”3 . Questo metodo è stato in generale accettato e ampiamente utilizzato per decenni, tuttavia, negli ultimi anni diverse organizzazioni al di fuori degli Stati Uniti (USA) hanno iniziato a rifiutarlo, in parte perché tale metodo era specifico alle normative statunitensi. A complicare ulteriormente le cose, alcune branche all'interno della stessa FDA (ad esempio il Center for Drug Evaluation and Research) non hanno più riconosciuto tale metodo (sviluppato dalla branca FDA Center for Device and Radiological Health), lasciando in una situazione difficile molti produttori di prodotti sterili. La motivazione del rifiuto di questo metodo a lungo utilizzato non è mai stata spiegata in modo soddisfacente, se non con il fatto che la FDA non fosse stata in grado di produrre prove a sostegno dello sviluppo del metodo. Ad oggi il metodo FDA è ancora largamente utilizzato, in gran parte perché non era stato ancora presentato alcun metodo alternativo, fino al luglio 2021, data di pubblicazione del metodo ISO 11138-8.
Il gruppo di lavoro 4 (WG4) della ISO/TC 198, Sterilization of health care products-Biological Indicators, é stato responsabile dello sviluppo dello standard RIT. Il Dr. John Gillis ha avuto un ruolo chiave nel suo sviluppo e ha condotto numerosi studi che hanno portato a diverse pubblicazioni4,5,6. In aprile 2012, Schneider e Gillis7 presentarono uno storico dettagliato del progetto RIT, avviato nel 2000, ritardato di diversi anni e riattivato nel 2007. Durante gli oltre 20 anni di vita del progetto, il WG4 ha proposto, testato e respinto numerosi metodi per la determinazione del RIT. Come spesso accade durante l’elaborazione di una nuova normativa, un dibattito rigoroso è sorto durante lo sviluppo del metodo. Da un lato, si sosteneva che a definire il RIT fosse l'ultima spora gravemente ferita e sopravvissuta al processo, argomento poi respinto in quanto ritenuto inutilmente restrittivo poiché impostava il RIT sulla base di dati considerati da molti "aberranti". Da un altro lato si sostenenva che il RIT dovesse essere definito sulle ultime 10-100 spore gravemente ferite. In questo secondo caso veniva eliminata la necessità di cercare la ridotta finestra di esposizione della frazione negativa che richiedeva tempo e risorse (una delle sfide caratterizzanti il metodo FDA), determinando il tempo di esposizione con un calcolo che mirava matematicamente a ottenere un basso numero di spore sopravvissute. Questa procedura fu poi considerata troppo tollerante, rendendo cosi non possibile correlare il numero calcolato di spore sopravvissute con il numero empiricamente determinato.
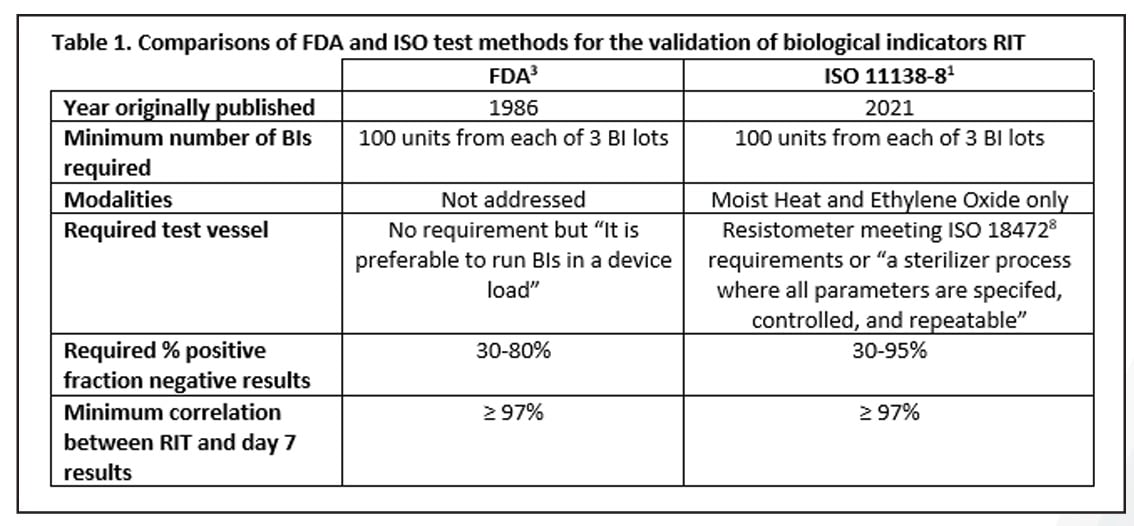
Quando il progetto normativo si è concluso, il metodo emerso da anni di test si situava tra le due opzioni sopra menzionate ed era stranamente simile al metodo FDA. I punti in comune tra i metodi FDA e ISO includono il numero di BI richiesti per test, la finestra della frazione negativa da individuare ed una correlazione minima del 97% tra il RIT e i risultati ottenuti a 7 giorni. Il metodo ISO consente una finestra di frazione negativa più ampia, sebbene sia limitato alle sole modalità di sterilizzazione a vapore e ossido di etilene. Il metodo ISO richiede l'uso di un resistometro8 o di uno sterilizzatore strettamente controllato per tutti i test mentre nel metodo FDA, questo punto non viene specificamente affrontato, sebbene sia indicato che i test debbano essere condotti in uno sterilizzatore di produzione. Una sintesi di questi dettagli è fornita nella tabella 1.
Come sopra menzionato, un limite dello standard ISO 11138-8 é la sua applicabilità ai soli processi di sterilizzazione a vapore e a ossido di etilene. Cosa si puo’ dire in merito alle altre modalità di sterilizzazione come il calore secco che sono state validate con successo col metodo FDA? Probabilmente i produttori di BI continueranno a convalidarli seguendo il metodo FDA e forse integreranno le loro dichiarazioni con i dati raccolti secondo il metodo di convalida ISO. Dopotutto, i due metodi sono quasi identici.
Gli utenti finali spesso si chiedono se l’esecuzione di studi sul RIT dei BI utilizzati nei loro processi sia un requisito anche per loro. La ISO 11138-8 fornisce una risposta a ciò quando afferma: “This document is applicable to manufacturers of biological indicators (BIs) and to end users of BIs who intend to, if required by their quality system, establish, validate or confirm a RIT.”1 Inoltre, lo standard rileva che non è necessario che gli utenti finali conducano questo test quando dichiara: “The RIT validation for a spore strip that includes a recovery medium as a kit or a self-contained BI does not have to be repeated by the end user as long as the end user uses the BI with same sterilizing agent and BI incubation temperature as that used in the validation”1.
Per concludere, con la pubblicazione dello standard ISO 11138-8 è stato stabilito un metodo di prova sviluppato e riconosciuto a livello internazionale per la convalida del RIT per gli Indicatori Biologici.
Quattro sono i principi chiave menzionati dalla organizzazione ISO nello sviluppo delle normative: queste ultime devono rispondere a un'esigenza del mercato, devono essere basate sull'opinione di esperti a livello globale, devono essere sviluppate attraverso un processo multi- stakeholder e sono basate su un consenso.
Lo standard ISO 11138-8 soddisfa tutti questi criteri ed è una gradita aggiunta alla serie ISO 11138.
Riferimenti
- ISO 11138–8: 2021, Sterilization of health care products—Biological indicators—Part 8: Method of validation of a reduced incubation time for a biological indicator.
- FDA Guide for Validation of Biological Indicator Incubation Time (1986).
- Guidance for Industry and FDA Staff - Biological Indicator (BI) Premarket Notification [510(k)] Submissions, October 4, 2007.
- J.R. Gillis, G. A. Mosley, J.B. Kowalski, G. Krushefski, P.T. Nirgenau, K.J. McCauley, “Understanding Biological Indicator grow-out Times”, Pharmaceutical Technology, 34, (1), Jan 2010.
- J.R. Gillis, G. A. Mosley, J.B. Kowalski, G. Krushefski, P.T. Nirgenau, K.J. McCauley, P.M. Schneider “Understanding Biological Indicator Grow-Out Times--Part II”, Pharmaceutical Technology, Jun 2013.
- J.R. Gillis P. M. Schneider, G. A. Mosley, J.B. Kowalski, G. Krushefski, K.J. McCauley “Establishing a Minimum Incubation Time for Biological Indicators”, Pharmaceutical Technology, Dec 2013.
- P.M. Schneider, J.R. Gillis, “Biological Indicator Growout Times: The Impact on Establishing a Reduced Incubation Time Protocol”, Pharmaceutical Technology, Vol 2012 Supplement, Issue 3 April 2012.
- ISO 18472: 2018, Sterilization of health care products—Biological and chemical indicators—Test equipment
SN071-V1