
Examen de la nouvelle norme ISO 11138-8 sur la validation d'un temps réduit d'incubation pour les indicateurs biologiques
Ecrit par Kurt MCCAULEY (Mesa Labs US)
Traduit en Français par Laurent BERLIET (Mesa Labs France)
[ Lire dans: Anglais | Espagnol | Italien ]
Mesa Labs fabrique ses indicateurs biologiques (BI) conformément aux normes applicables.Une nouvelle norme ISO pour la validation d'un temps réduit d'incubation (RIT) des BI a été publiée et fait l'objet de ce SporeNews. La norme a été désignée comme ISO 11138-81 et est le dernier ajout à la série ISO 11138 qui est entièrement dédiée aux BI. Cette norme est applicable aux fabricants de BI ainsi qu'aux utilisateurs finaux qui souhaitent établir ou confirmer un RIT.
Avant la publication de la norme ISO 11138-8, la seule méthode de RIT disponible, qui avait été publiée par la Food and Drug Administration (FDA)2 en 1986, avait été incorporée dans un document référence de la FDA intitulé « Biological Indicator (BI) Premarket 510(k) Submissions »3 . Cette méthode a été généralement acceptée dans le monde entier et a été largement utilisée pendant des décennies, mais ces dernières années, plusieurs organisations en dehors des États-Unis (USA) ont commencé à rejeter la méthode d’essai, en partie parce que la méthode était spécifique à la réglementation des États-Unis. Pour compliquer davantage les choses, une branche de la FDA elle-même (c.-à-d. le Center for Drug Evaluation and Research) ne reconnaissait plus la méthode (développée par le Center for Device and Radiological Health de la FDA), laissant de nombreux fabricants de produits stériles dans une situation difficile. La justification du rejet de cette méthode utilisée de longue date n’a jamais été expliquée de façon satisfaisante, si ce n’est que la FDA n’a pas été en mesure de produire des preuves à l’appui de l’élaboration de la méthode. À ce jour, la méthode de la FDA est encore largement utilisée, en grande partie parce qu’aucune autre méthode n’avait été présentée, et ce jusqu’en juillet 2021, lorsque la méthode ISO 11138-8 a été publiée.
Le Groupe de travail 4 (WG4) de l’ISO/TC 198, Stérilisation des produits de soins de santé -Indicateurs biologiques, était responsable de l’élaboration de cette norme RIT. Le Dr John Gillis a joué un rôle clé dans cet effort et a dirigé de nombreuses études qui ont données lieu à plusieurs publications4,5,6. En avril 2012, Schneider et Gillis7 ont présenté un historique détaillé du projet RIT, lancé en 2000, retardé de plusieurs années et réactivé en 2007. Durant plus de 20 années de la durée de vie du projet, WG4 a proposé, testé et rejeté de nombreuses méthodes pour la détermination du RIT. Comme c’est souvent le cas pour l’élaboration de normes, un débat rigoureux a suivi tout au long de l’élaboration de la méthode. D’un côté, on a fait valoir que la dernière spore gravement blessée qui survit au processus devrait fixer le RIT. Cela a été rejeté, car il a été jugé inutilement restrictif et fixait le RIT en fonction de ce que la plupart considéraient comme des données « aberrantes ». D’un autre côté, on a fait valoir que le RIT devrait être fondé sur les 10 à 100 dernières spores gravement blessées. Cette méthode permettait d’ éliminer le besoin de cibler une fenêtre d’exposition des fractions négatives stricte necessitant beaucoup de temps et de ressources (un des défis avec la méthode de la FDA). Le temps d’exposition était, dans ce cas, determiné par un calcul, ciblant mathématiquement de faibles nombres de spores survivantes; cependant, cette méthode a été jugée trop clémente, et il était difficile de corréler le nombre calculé de spores survivantes avec le nombre empiriquement déterminé de spores survivantes.
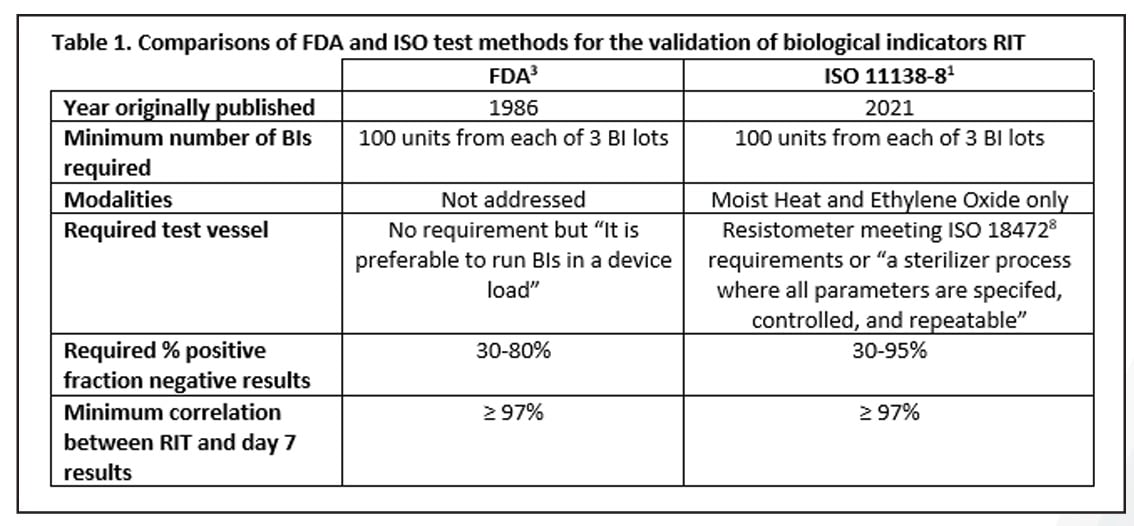
À la fin du projet, la méthode qui a émergé de ces plusieurs années de tests se situait quelque part entre les deux options mentionnées ci-dessus et était étrangement similaire à la méthode de la FDA. Les points communs entre les méthodes FDA et ISO incluent le nombre de BI requis par test, ciblant une fenêtre de fraction négative, et une corrélation minimale de 97% entre le RIT et les résultats à 7 jours. La méthode ISO autorise une fenêtre de fractions négatives plus grande, mais sa méthode est limitée aux modalités de chaleur humide et d'oxyde d'éthylène uniquement. La méthode ISO nécessite l'utilisation d’un résistomètre8 ou un stérilisateur étroitement contrôlé pour tous les tests alors qu'avec la méthode FDA, cela n'est pas spécifiquement abordé, bien qu'il soit indiqué que les tests soient effectués dans un stérilisateur de production. Un résumé de ces détails est fourni dans le tableau 1.
Une des limites de la norme ISO 11138-8 (comme indiqué ci-dessus) est qu'elle n'est applicable qu'aux procédés de stérilisation à la chaleur humide et à l'oxyde d'éthylène. Qu'est-ce que cela signifie concernant les autres modalités de stérilisation telles que la chaleur sèche qui ont aussi été validées avec succès par la méthode FDA?
Le résultat probable sera que les fabricants de BI continueront à valider ces BI selon la méthode de la FDA et compléteront peut-être leurs déclarations avec des données collectées selon la méthode de validation ISO. Après tout, les deux méthodes sont presque identiques.
Les utilisateurs finaux se demandent souvent s'il est obligatoire pour eux aussi d'effectuer des études RIT sur les BI utilisés dans leurs processus. L'ISO 11138-8 apporte une réponse à cela, lorsqu'elle mentionne : “This document is applicable to manufacturers of biological indicators (BIs) and to end users of BIs who intend to, if required by their quality system, establish, validate or confirm a RIT.”1 De plus, la norme note qu'il n'est pas nécessaire que les utilisateurs finaux effectuent ce test puisqu'elle mentionne : “The RIT validation for a spore strip that includes a recovery medium as a kit or a self-contained BI does not have to be repeated by the end user as long as the end user uses the BI with same sterilizing agent and BI incubation temperature as that used in the validation”1.
Pour conclure, avec la publication de la norme ISO 11138-8, une méthode d'essai développée et reconnue internationalement pour la validation d'un RIT pour les indicateurs biologiques a été établie.
Il existe quatre principes clés notés par l'ISO dans l'élaboration des normes ; les normes doivent répondre à un besoin du marché, sont basées sur l'opinion d'experts mondiaux, sont élaborées par le biais d'un processus multipartite et reposent sur un consensus.
La norme ISO 11138-8 répond à tous ces critères et est un ajout bienvenu à la série ISO 11138.
- ISO 11138–8: 2021, Sterilization of health care products—Biological indicators—Part 8: Method of validation of a reduced incubation time for a biological indicator.
- FDA Guide for Validation of Biological Indicator Incubation Time (1986).
- Guidance for Industry and FDA Staff - Biological Indicator (BI) Premarket Notification [510(k)] Submissions, October 4, 2007.
- J.R. Gillis, G. A. Mosley, J.B. Kowalski, G. Krushefski, P.T. Nirgenau, K.J. McCauley, “Understanding Biological Indicator grow-out Times”, Pharmaceutical Technology, 34, (1), Jan 2010.
- J.R. Gillis, G. A. Mosley, J.B. Kowalski, G. Krushefski, P.T. Nirgenau, K.J. McCauley, P.M. Schneider “Understanding Biological Indicator Grow-Out Times--Part II”, Pharmaceutical Technology, Jun 2013.
- J.R. Gillis P. M. Schneider, G. A. Mosley, J.B. Kowalski, G. Krushefski, K.J. McCauley “Establishing a Minimum Incubation Time for Biological Indicators”, Pharmaceutical Technology, Dec 2013.
- P.M. Schneider, J.R. Gillis, “Biological Indicator Growout Times: The Impact on Establishing a Reduced Incubation Time Protocol”, Pharmaceutical Technology, Vol 2012 Supplement, Issue 3 April 2012.
- ISO 18472: 2018, Sterilization of health care products—Biological and chemical indicators—Test equipment
SN071-V1