VOL 15, NO 2
Studio del valore D nel prodotto - Parte 2, Liquidi acquosi termosensibili e atipici

Di Laurent Berliet e Silvia Rizzi di MesaLabs France
Per prodotti termosensibili e cicli con basso F0 si adopera preferibilmente il metodo Indicatore Biologico-Bioburden che offre la possibilità di utilizzare un indicatore biologico (BI) commerciale liquido ad immersione come MagnaAmp o SterilAmp inoculati con una popolazione inferiore (104 per esempio) di Geobacillus stearothermophilus, o SterilAmp inoculate con Bacillus subtilis 5230.
Quando le caratteristiche del prodotto possono essere degradate dai processi di sterilizzazione overkill, i parametri tempo e temperatura devono essere rivalutati in modo da non compromettere la qualità del prodotto.
In questi casi, l'approccio di validazione si basa sul metodo Indicatore biologico-Bioburden.
Questo approccio richiede una conoscenza approfondita del bioburden iniziale e dell'impatto del prodotto sulla resistenza degli organismi per poter selezionare BI con una popolazione e una resistenza adeguate alla convalida della sterilizzazione (USP <1229.2>). Tale metodo si basa quindi su uno studio comparativo tra la resistenza e la popolazione del bioburden presente rispetto al BI che sarà utilizzato per eseguire la validazione (Figura 1).
In questo approccio G. stearothermophilus può essere utilizzato con popolazioni inferiori a 106 (ma non a 103 ); tuttavia, B. subtilis 5230 con una popolazione di 106 e una resistenza inferiore rispetto a G. stearothermophilus è particolarmente indicato e citato nella ISO 11138 e USP. B. subtilis 5230 rimane uno dei ceppi sin’ora conosciuti più resistenti alla sterilizzazione a vapore, pur consentendo una significativa riduzione della letalità del ciclo applicato per raggiungere un livello di assicurazione sterilità (SAL) di 10-6. Il metodo richiede il controllo della carica batterica, l'identificazione degli isolati del bioburden e il test di resistenza (studio del valore D) degli organismi sporigeni, per garantire che siano meno resistenti di B. subtilis 5230 utilizzato come microrganismo di prova (Figura 1).
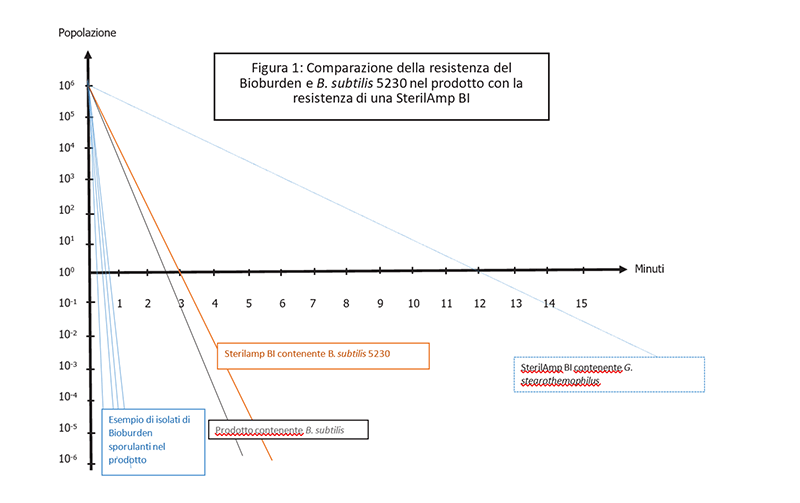
In Figura 1 le curve di sopravvivenza di quattro isolati del bioburden del prodotto sono confrontate con B. subtilis 5230 per la resistenza termica nelle stesse condizioni. In questo caso, B. subtilis mostra una resistenza significativamente maggiore rispetto agli organismi della carica batterica e può quindi essere utilizzato come microrganismo di prova per sfidare il processo di sterilizzazione. Poiché il prodotto può avere un impatto differente sulla resistenza delle spore (aumento, diminuzione o nessun impatto), il passo successivo è valutare la resistenza delle spore di B. subtilis nel prodotto prima di scegliere un BI per la convalida. Ciò si ottiene conducendo uno studio del valore D con B. subtilis inoculato nel prodotto.
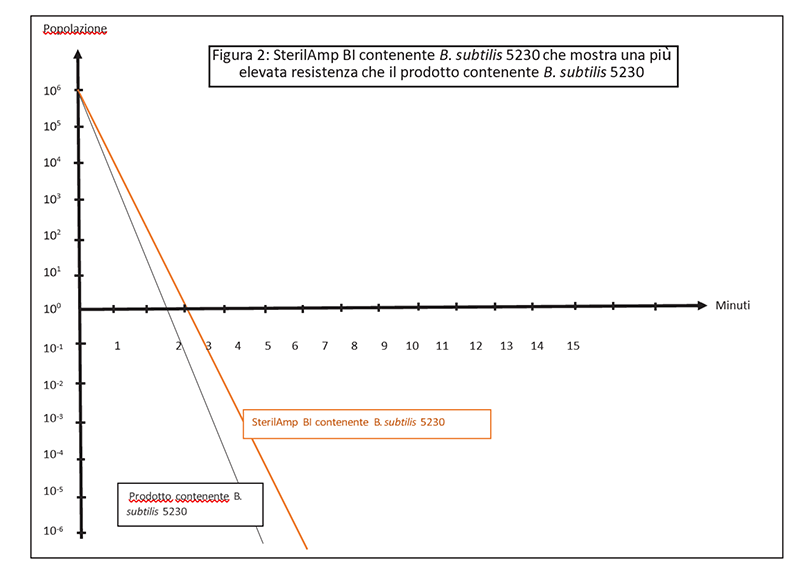
In questo primo esempio, l'uso di un BI SterilAmp standard inoculato con B. subtilis 5230 è appropriato in quanto il valore D riportato sul CoA è uguale o maggiore al valore D del microrganismo quando testato direttamente nel prodotto, di conseguenza fornisce una sfida adeguata per garantire un SAL accettabile per il prodotto sterilizzato (Figura 2).
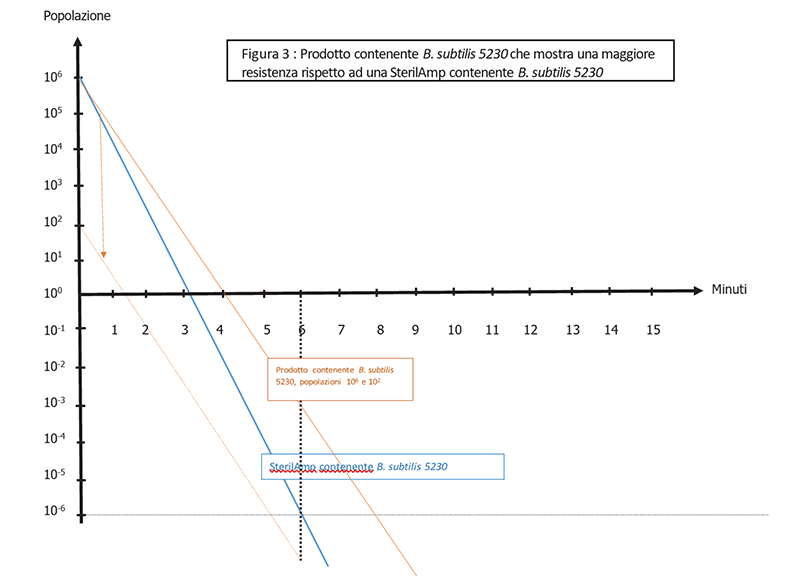
In Figura 3 é illustrata un'altra possibilità : se il valore D di B. subtilis nel prodotto è superiore al valore D di una SterilAmp inoculata con B. subtilis, allora il BI non rappresenta lo scenario peggiore. Questa maggiore resistenza potrebbe essere causata dal prodotto che provoca l'aggregazione delle spore o le scherma dall’agente sterilizzante, come spiegato nella Spore News Vol 15, No 1 "Perché eseguire uno studio del valore D nel prodotto?".
A volte, la risposta non è così semplice. Contrariamente alla maggior parte dei prodotti acquosi il cui impatto sulla letalità non influisce sulla linearità della cinetica di distruzione microbica, gli studi del valore D su gel o altri prodotti la cui consistenza può essere modificata durante la sterilizzazione, possono mostrare una letalità bifasica. L'origine di questa letalità bifasica rimane difficile da determinare, a causa di aggregati o cambiamenti nelle proprietà reologiche del prodotto (come reticolazione di polimeri, ecc.).
Quando si esegue uno studio del valore D partendo da 106 spore di un organismo di prova, è possibile ottenere risultati non lineari. Un esempio di questo fenomeno è quando osserviamo due diverse pendenze che caratterizzano la distruzione delle spore: la prima pendenza, caratterizzata da una più rapida distruzione delle spore (valore D più basso), e una seconda pendenza caratterizzata da una distruzione più lenta (valore D più alto). La maggiore resistenza della seconda fase è correlata a tempi di esposizione più lunghi necessari per distruggere gli ultimi log della popolazione inoculata. (Figura 4).
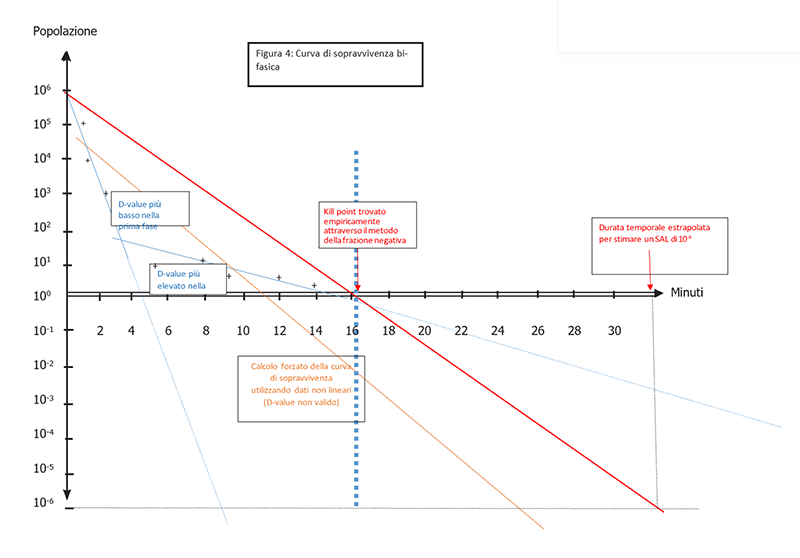
Quando uno studio del valore D di un prodotto evidenzia una curva bifasica, la soluzione diventa più complessa. È possibile effettuare un calcolo del "valore D" forzato, ma non è possibile estrapolare un SAL accurato da dati non lineari. Gli standard non affrontano queste situazioni al momento. Un approccio possibile consiste nel trovare e confermare empiricamente il punto di uccisione delle spore tramite il metodo della Frazione Negativa che identifica l'intervallo di tempo in cui viene raggiunto un minimo di 6 riduzioni logaritmiche di spore (SLR). Questo punto temporale può quindi essere raddoppiato per stimare un SAL di 10-6. Questo approccio potrebbe essere applicato a qualsiasi cinetica di letalità non lineare.
La sterilizzazione e la convalida microbiologica dei prodotti sensibili al calore richiedono la comprensione del comportamento termico del prodotto durante il trattamento termico. Oltre a comprendere l'effetto del prodotto sulla resistenza delle spore in relazione al BI utilizzato per monitorare il ciclo, ci sono molti altri elementi che devono essere considerati durante lo sviluppo del ciclo del prodotto, inclusi il materiale di imballaggio e la configurazione, o altri parametri potenzialmente da valutare (ad es. valore Z). Queste considerazioni aiuteranno a eseguire una analisi coerente del valore D per poter sviluppare una robusta strategia di convalida.
Circa l'autore
Scritto da Silvia RIZZI e Laurent BERLIET, di MESALABS France- Divisione SDC Controllo Sterilizzazione e Disinfezione. Laurent ha iniziato a lavorare nel 2010 come rappresentante tecnico commerciale con Amilabo che è diventata Mesa Labs France. Ha conseguito una laurea di biologia e geologia presso l'Università di Lione, Francia. Silvia ha iniziato la sua carriera in Mesa Labs France nel 2016 come rappresentante tecnico commerciale. Ha conseguito una Laurea Magistrale in Ingegneria Chimica presso l'Università degli Studi di Napoli, Italia. Supportano e formano aziende dei settori farmaceutico, biotecnico e industrie di dispositivi medici, trovando soluzioni idonee per convalidare processi di sterilizzazione e decontaminazione.