VOL 15, ISSUE 2
Les études de valeur D - Partie 2 Les liquides aqueux atypiques et thermosensibles

Par Laurent Berliet et Silvia Rizzi de MesaLabs France
[ Lire en: Anglais | Espagnol | Italien ]
Pour les produits thermosensibles et les cycles à faible F0, La méthode de validation par combinaison d’Indicateur Biologique /charge biologique est préférable avec la possibilité d'utiliser des indicateurs biologiques (IB) sous forme d’ampoules submersibles tels que MagnaAmp ou SterilAmp inoculés avec une population plus faible (104) de G.stearothermophilus, ou des SterilAmp inoculés avec B.subtilis 5230.
En effet, lorsque les caractéristiques d’un produit peuvent être dégradées par une stérilisation dite « Overkill », les paramètres de temps et/ou de température doivent être adaptés afin de ne pas affecter la qualité du produit.
Dans ce cas, l'approche de validation devra être basée sur la méthode par combinaison de l'indicateur biologique / la charge biologique (BI/Bioburden). Cette approche nécessite une connaissance approfondie de la biocharge initiale et de l’impact du produit sur la résistance des organismes pour pouvoir sélectionner le BIs adéquat avec une population et une résistance adaptée afin de valider la stérilisation (USP <1229.2>). Cette méthode repose donc sur une étude comparative entre la résistance et la population de la charge biologique présente par rapport à l’indicateur biologique qui sera utilisé lors de la validation (Figure 1).
Dans cette approche, G.stearothermophilus peut être utilisé avec des populations plus faibles (pas < 103) ; cependant ce challenge restant parfois trop élevé, l’utilisation de B.subtilis 5230 avec une population de 106 mais une résistance plus faible que G.stearothermophilus peut être plus appropriée, telle qu’indiquée dans l'ISO 11138, l’USP et la PE. En effet, B. subtilis 5230 reste l'une des souches connues les plus résistantes à la stérilisation vapeur, tout en permettant une réduction très significative du cycle appliqué pour atteindre un niveau d'assurance de stérilité (SAL) de 10-6. Cette méthode nécessite le contrôle strict de la charge biologique, avec en particulier une identification et des tests de résistance (étude de la valeur D) sur les formes sporulantes, pour garantir qu'elles soient moins résistantes que B.subtilis 5230 utilisé comme micro-organisme de référence (Figure 1).
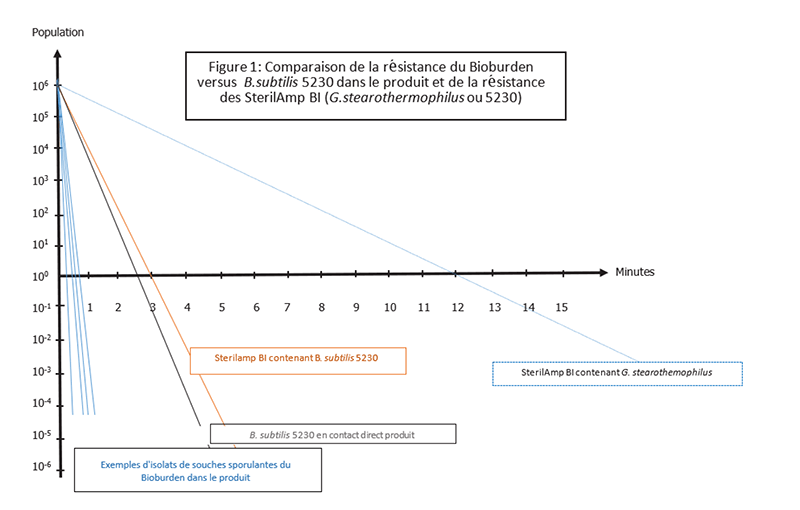
Dans le graphique ci-dessus, les courbes de survie de quatre isolats de la biocharge du produit sont comparées à la résistance du B.subtilis 5230, dans les mêmes conditions et au contact du produit. Dans cet exemple, B.subtilis présente une résistance significativement plus élevée que les organismes du Bioburden et peut donc être utilisé comme micro-organisme d'essai pour valider la stérilisation. De plus, le produit pouvant avoir des effets variables sur la résistance des spores (augmentation, diminution ou aucun impact), l'étape suivante consiste à comparer cette résistance de B.subtilis dans le produit et celle des BIs standard pour pouvoir choisir le BI pour les validations. Cela nécessite donc des études de valeur D comparatives entre B.subtilis inoculé dans le produit et le BI.
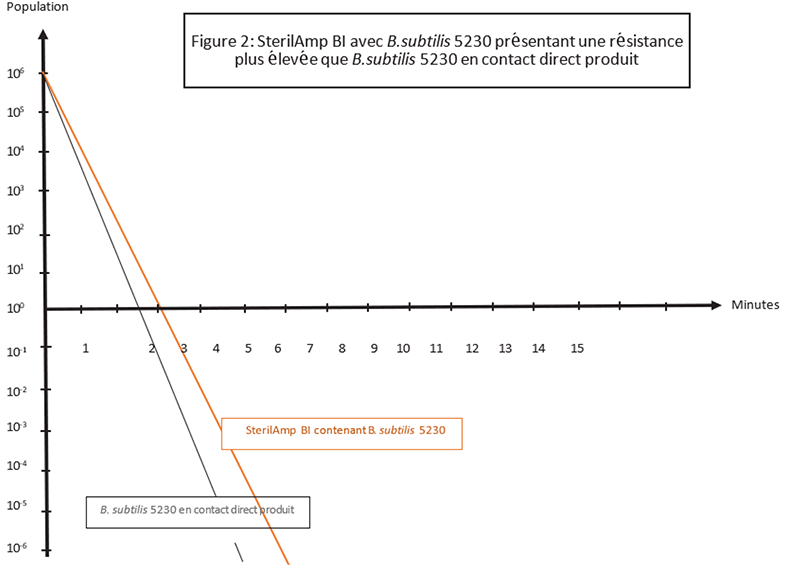
Dans ce premier exemple, l'utilisation du BI SterilAmp standard, inoculé avec B.subtilis 5230 serait approprié puisque la D-value du BI est supérieure à la valeur D du micro- organisme lorsqu'il est testé directement dans le produit, fournissant ainsi un challenge approprié (worst case) pour garantir le NAS revendiqué sur le produit stérilisé (Figure 2).
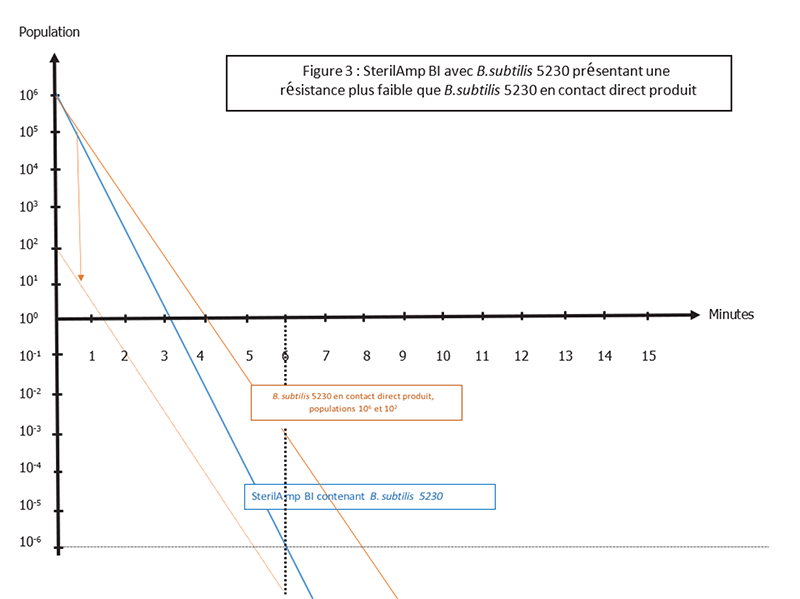
L’autre possibilité serait que la valeur D du B.subtilis dans le produit soit supérieure à la valeur D d'un SterilAmp 5230, alors le BI ne représenterait pas le worst case. (Figure 3) Cette résistance accrue peut avoir diverses origines comme la formation d’amas ou d’une protection de surface, comme expliqué dans Spore News Vol 15, No 1 « Pourquoi effectuer une étude sur la valeur D au contact direct d’un produit liquide ? ».
Enfin et dans quelques cas particuliers, on peut aboutir à des cas complexes. Contrairement à la plupart des produits aqueux dont l'impact sur la résistance n'affecte pas la linéarité de la létalité, certaines études de valeur D sur gels ou autres produits dont la texture peut être modifiée lors de la stérilisation, peut aboutir à une létalité biphasique. L'origine de cette létalité biphasique peut être difficile à déterminer, elle peut être due à la formation d’agrégats ou due au changement de propriétés rhéologiques du produit (telles que la réticulation des polymères, etc.).
Lorsqu'une étude de la valeur D est réalisée à partir de 106 spores d'un organisme d'essai, il est possible d'aboutir à des résultats non linéaires. Un exemple de ce phénomène observable fait apparaitre deux pentes différentes caractérisant la destruction des spores : une première pente avec une destruction plus rapide (valeur D plus faible) en début d’exposition puis une deuxième phase avec une destruction plus lente (valeur D plus élevée) au cours de l'exposition.
La résistance plus élevée de la deuxième phase est corrélée à un temps d’exposition nécessaire plus important pour détruire les dernières spores de la population inoculée (Figure 4).
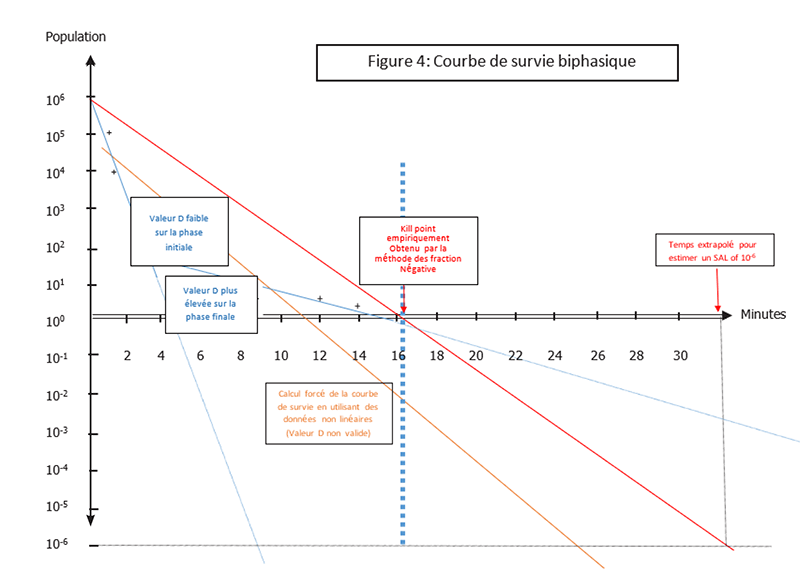
Lorsqu'une étude de la valeur D d’un produit aboutit à une courbe biphasique, son exploitation devient plus complexe. Un calcul de « valeur D » peut être réalisé avec les données recueillies, mais un SAL précis ne peut pas être extrapolé à partir de données non linéaires. Les normes ne traitent pas ces situations. Une approche possible consiste à trouver et à confirmer empiriquement le « Kill Time » via la méthode des « fractions négatives », ce qui permet simplement d’identifier un temps d’exposition correspondant au moins à une réduction logarithmique de six logs de spores (SLR). Ce temps peut ensuite être doublé pour estimer un SAL de 10-6. Cette approche pourrait être appliquée à toute cinétique de létalité non linéaire.
La stérilisation et la validation microbiologique des produits thermosensibles nécessitent donc de comprendre le comportement thermique du produit lors de sa stérilisation. En plus de la compréhension de l'impact du produit sur la résistance des spores et sa relation avec le BI utilisé pour valider le cycle, il y a également beaucoup d'autres éléments qui doivent être pris en compte pendant le développement du cycle appliqué au produit, y compris le matériel d'emballage et la configuration, ou d'autres paramètres qui peut avoir besoin d'être calculé (par exemple, la valeur Z). Toutes ces considérations doivent être prises en compte pour réaliser une étude cohérente de la valeur D et pouvoir l’exploiter dans le but de garantir une validation robuste du cycle développé.
À propos des auteurs
Rédigé par Silvia RIZZI et Laurent BERLIET, de MESALABS France- Division Stérilisation et Contrôle de la Désinfection. Laurent a commencé à travailler en 2010 comme technico-commercial chez Amilabo qui est devenu Mesa Labs France. Il est titulaire d'une Licence de Biologie et Géologie de l'Université de Lyon, France. Silvia a commencé sa carrière chez Mesa Labs France en 2016 en tant que technico-commerciale, elle est titulaire d'un diplôme d'ingénieur chimiste de l'Université de Naples, Italie. Ils soutiennent et forment les entreprises des industries pharmaceutiques, biotechniques et des dispositifs médicaux en trouvant des solutions cohérentes pour valider les processus de stérilisation et de décontamination.